- Contar el modelo.
- Poner una foto del átomo según el modelo.
- Buscar una página donde haya una animación interactiva del modelo (extensión .swf) y poner un enlace a esa página.
- Modelo atómico de Dalton.
- Modelo atómico de Thomson.
- Modelo atómico de Rutherford.
Introduce la idea de la discontinuidad de la materia, es decir, ésta es la primera teoría científica que considera que la materia está dividida en átomos (dejando aparte a precursores de la Antigüedad como Demócrito y Leucipo, cuyas afirmaciones no se apoyaban en ningún experimento riguroso).
Los postulados básicos de esta teoría atómica son:
Los postulados básicos de esta teoría atómica son:
1. La materia está dividida en unas partículas indivisibles e inalterables, que se denominan átomos.
2. Todos los átomos de un mismo elemento son idénticos entre sí (presentan igual masa e iguales propiedades).
3. Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
4. Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
Animación Dalton
MODELO ATÓMICO THOMSON: Introduce la idea de que el átomo puede dividirse en las llamadas partículas fundamentales:
.Electrones, con carga eléctrica negativa
.Protones, con carga eléctrica positiva
.Neutrones, sin carga eléctrica y con una masa mucho mayor que la de electrones y protones.
Thomson considera al átomo como una gran esfera con carga eléctrica positiva, en la cual se distribuyen los electrones como pequeños granitos (de forma similar a las pepitas de una sandía).

Animación Thomson
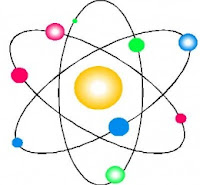
MODELO ATÓMICO DE RUTHERFORD:
En 1911, Rutherford introduce el modelo planetario, que es el más utilizado aún hoy en día. Considera que el átomo se divide en:
· Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo).
· Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparado con el tamaño de todo el átomo: el átomo está practicamente hueco.
· Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
Los experimentos de Rutherford demostraron que el núcleo es muy pequeño comparado con el tamaño de todo el átomo: el átomo está practicamente hueco.